Quirónsalud
Blog del Dr. Mauro Javier Oruezábal Moreno. Oncología médica. Hospital Universitario Rey Juan Carlos
- 201615jun
Compartir información confidencial, clave en cáncer
Ahora más que nunca los pacientes son claves para el desarrollo de la ciencia, sobre todo en la genómica y particularmente en cáncer. Siempre los pacientes han sido esenciales en los avances científicos, desde el mismo momento en que comparten sus experiencias y vivencias con el médico, informan sobre acontecimientos que debemos estudiar, o cuando participan en un ensayo clínico destinado a contestar una pregunta de interés científico. Sin embargo, en este momento que somos capaces de secuenciar el genoma a una velocidad de bólido, y que mucha de esta información puede ser trascendente en la toma de decisiones, aún más.
Vivimos en una época en la que la información clínica es confidencial y los centros sanitarios, al igual que cualquier empresa, están obligados a garantizar la privacidad de la misma, con unas medidas de seguridad máxima, y penada por la ley en caso de incumplimiento. Estamos acostumbrados a trabajar bajo estas normas, y cualquier excusa debe seguir un protocolo complejo que incluye la solicitud de permisos, la evaluación por un comité de investigación y bioética, la firma de un consentimiento informado y la anonimización de los resultados.
Sin embargo, la ciencia ha virado 180º desde la entrada de la genómica, dado que gran parte de los avances requieren del análisis de millones de datos para los cuales es preciso compartir esta información en bases de datos internacionales que funcionan con la máxima "win to win". Por supuesto estas bases de datos trabajan con rigurosas medidas de seguridad en las que un usuario autorizado puede subir la información genómica de un paciente, a la vez que descargarse archivos que otros colegas han querido compartir. Es una idea que nació con plataformas muy sociales como Facebook o Twitter, y que están calando hondo en el mundo científico.

Personal Genome Project es una plataforma colaborativa de la Universidad de Harvard cuyo objetivo es compartir datos genómicos y de salud de miles de participantes. Ya se dispone de información de más de 16.000 pacientes, quienes voluntariamente ceden la información genómica y sobre su enfermedad para ser analizada por miles de investigadores de todo el mundo. Este proyecto fue iniciado por George Church en la Escuela de Medicina de Harvard en el año 2005, y ha sido pionero en aspectos éticos, legales y técnicos relacionados con la creación de los recursos públicos de datos de carácter altamente identificables como el genoma humano.
La privacidad, la confidencialidad y el anonimato son imposibles de garantizar en un contexto como este proyecto de investigación donde el intercambio público de los datos genéticos es un objetivo explícito. Por lo tanto, Personal Genome Project colabora con los participantes que son plenamente conscientes de las consecuencias y los problemas de privacidad de hacer pública su información. La participación supone entrar en una red de colaboración donde todos los usuarios se benefician de un seguimiento de la salud y otros rasgos clínicos que se pueden desarrollar con el tiempo por interacción con el ambiente; se analizan los beneficios y riesgos relacionados con el acceso y el intercambio del genoma personal; se conecta a los participantes con proyectos de investigación, de educación y sociales relacionados a los datos de su genoma personal.
En definitiva, se mantiene unas fuertes relaciones con los participantes, de tal modo, que barreras insoslayables hoy día como es la confidencialidad de la información, quede superado por la voluntariedad de los participantes.
Sin embargo, no todo es tan fácil como parece, y muchas veces "compartir" y "confidencialidad" chocan de pleno, y la clave está en el modo y el momento en el que el usuario ha dado su consentimiento. Un ejemplo clave es Google Deepmind, una empresa inglesa, partner de Google, dedicada a la inteligencia artificial, y que está trabajando con el National Health System del Reino Unido para analizar la información clínica de los pacientes. Los resultados pueden ser de gran ayuda para la planificación de los servicios de salud o revelar puntos esenciales en la organización, utilización de recursos, seguimiento de enfermedades, educación sanitaria o conocer el efecto que el ambiente puede tener en el desarrollo y evolución de una enfermedad. Sin embargo, es fundamental para la salud que la persona que recibe el cuidado o tratamiento, dé su consentimiento y entienda el beneficio que puede suponer el compartir y analizar esta información.
El punto más controvertido está cuando se analizan los distintos beneficios que se pueden obtener del análisis de esta información, dado que existen beneficios directos, relacionados con la elección del tratamiento o los cuidados de salud, y otros indirectos como información para investigación, auditorias de servicios o provisión de pagos. La barrera no es clara y existen elementos comunes y sinergias que pueden hacer que la salud de las personas mejoren al haber cambios organizativos o proyectos de investigación en marcha, por lo que aunque se quiera acotar el consentimiento del paciente a los beneficios directos, una visión más amplia puede dar resultados mayores y mejores a más largo plazo. En este sentido es clave la reforma del Reglamento 2016/679 del Parlamento y Consejo Europeo que expone que el tratamiento de datos personales debe estar concebido para servir a la humanidad, y el derecho a la protección de los datos personales no es un derecho absoluto sino que debe considerarse en relación con su función en la sociedad y mantener el equilibrio con otros derechos fundamentales, con arreglo al principio de proporcionalidad.
Esta claro que compartir información puede mejorar la salud de la población, y es posible si el interesado ha dado su consentimiento explícito para el tratamiento de dichos datos personales con uno o más de los fines especificados, siendo esencial expresar cada uno de los usos que van recibir los datos. Ya no estamos en la era de la información. Estamos en la era de la gestión de la información.
0 comentarios - 201620may
La ciencia nunca resuelve un problema sin crear otros 10 más
Siguiendo con el hilo de los últimos avances terapéuticos frente al cáncer, recientemente se ha aprobado un fármaco llamado olaparib que actúa directamente frente a las células que presentan mutaciones en los genes llamados BRCA 1 o 2, acrónimos en inglés de "Breast Cancer". La indicación actual de este fármaco es para pacientes que padecen cáncer de ovario, del que han recaído y siguen respondiendo a un tratamiento con cisplatino o carboplatino. Es decir, es un tratamiento que se administra como mantenimiento, una vez que se ha logrado una respuesta máxima con unos fármacos muy eficaces en este tipo de tumor, los llamados de forma coloquial platinos, en sus distintas versiones, cisplatino o carboplatino.
Es llamativo que estos fármacos, que son como bombas para los tumores, se sigan manteniendo en primera linea después de más de 35 años desde que la FDA (Food and Drug Administration) aprobara por primera vez su uso en humanos en 1978. En este tiempo ha habido muchos avances, pero el olaparib es el primer fármaco dirigido frente a aquellas células que presentan una mutación genética.
La razón de que se haya comenzado a utilizar en el cáncer de ovario es debido a que el porcentaje de mutaciones genéticas en BRCA 1 o 2 es mayor en términos relativos en comparación a otros tumores, aunque ya se está evaluando este fármaco en otros tipos de cáncer que presentan también una mutación en uno de estos dos genes, como el cáncer de mama, páncreas, gástrico, próstata, pulmón, tumores de cabeza y cuello y cerebrales. Muchos de ellos actualmente tienen un tratamiento muy distinto, sin embargo, el descubrimiento de la genética en cáncer está suponiendo un cambio drástico en toda la oncología, algo que es esperable vaya a más en el futuro. De hecho, todos los tumores que hemos enumerado, y que a priori no deberían tener nada en común más allá de la denominación "cáncer", pueden presentar mutaciones en unos genes que se consideran claves para muchas células por codificar la secuencia de proteínas esenciales para la reparación del DNA (ácido desoxirribonucleico).
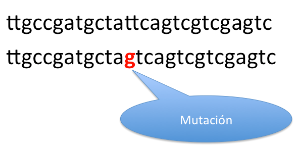
Para entender el funcionamiento del olaparib vamos a hacer un pequeño viaje al interior de una célula, y más concretamente a su núcleo, donde se encuentra el DNA que controla el funcionamiento de la misma. Cada célula del organismo funciona como una fábrica con autonomía propia, pero para pertenecer al cuerpo humano se pide coordinación con el resto de células, de tal modo, que su división, proliferación o diferenciación está programada en conjunto con el resto de células: un bonito ejemplo de disciplina y convivencia. Entre los genes que forman parte del DNA existen algunos vitales, denominados "guardianes del genoma", ya que su activación o desactivación, suponen un punto crítico para la célula, indicando el momento de cambio de estado. Por otra parte, existen otra serie de genes que actúan como "policías" y garantizan que una vez se ha iniciado un proceso, éste sea desarrollado de un modo perfecto, sin ningún tipo de error, y en el caso de que surjan problemas, solucionarlos. Dentro de este grupo de "genes policías" estarían los genes BRCA 1 y 2, que codifican unas proteínas que intervienen en la reparación del DNA cuando existen errores durante la replicación. BRCA 1 y 2 intervienen una vez la replicación del DNA ha finalizado, es decir, revisa que la secuencia del DNA copiada sea exacta a la original y repara los defectos que hayan podido surgir. Este mecanismo es conocido como reparación por recombinación homóloga. Otras proteínas llamadas poli (ADP-ribosa) polimerasa son las encargadas de reparar el DNA en el momento que surge el error, parando la "fotocopiadora", borrando el error, y reiniciando de nuevo la "fotocopiadora". Ambos mecanismos garantizan que la copia final sea exacta a la original, y de este modo se trasmite toda la información genética de una célula inicial a dos células hijas, con la programación necesaria para formar parte de un mismo tejido. Si pensamos por un momento en lo que podría pasar si estos errores no fueran reparados, intuiremos fácilmente que la probabilidad de ir acumulando errores aumenta exponencialmente a medida que las células se dividen, generando grupos de células que proliferarán a sus anchas y se diferenciarán de modo independiente al resto del tejido: es el origen de un tumor.
Ahora resulta más fácil entender que una persona que presente mutaciones en los genes BRCA 1 o 2 tiene un mayor riesgo de desarrollar tumores en todas aquellas localizaciones en las que los genes BRCA 1 y 2 intervienen en la reparación del DNA, fundamentalmente en las células de la mama, ovario, próstata, páncreas, etc, y es por ello que aunque hoy día los tumores en estas localizaciones se tratan de un modo distinto, aquellos tumores que presenten mutaciones en BRCA 1 o 2, pueden tener un mismo origen, y requerir tratamientos similares. Es un concepto que esta cambiando desde la introducción de la genómica en cáncer y que hará que el tratamiento del cáncer no dependa tanto de la localización del tumor, sino del perfil genómico del tumor.
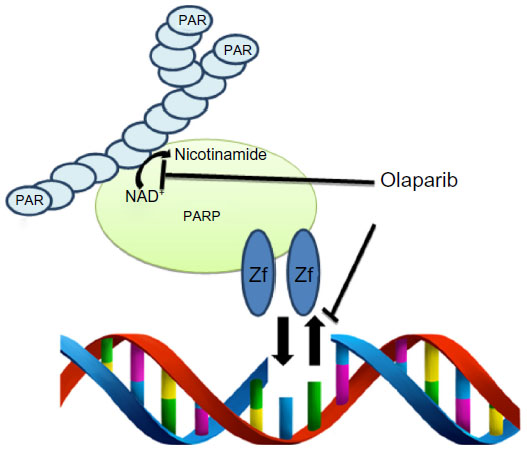 El olaparib es un fármaco clasificado como inhibidor poli (ADP-ribosa) polimerasa que bloquea en las células tumorales el mecanismo de reparación del DNA por escisión de bases en una única hebra, y que en las células con mutaciones en BRCA 1 o 2 provoca que en pocas divisiones celulares, el daño en el DNA sea tan grande que la célula no pueda sobrevivir. Es el objetivo del olaparib, impedir que las células con mutaciones en BRCA 1 o 2 mueran por acumulación de millones de errores en su DNA. Esta hipótesis ha sido confirmada en ensayos clínicos en mujeres con cáncer de ovario recidivado y que han respondido a un tratamiento previo con cisplatino o carboplatino, permitiendo casi triplicar el tiempo sin progresión de la enfermedad comparado con un grupo de pacientes que recibieron sólo placebo; además la tolerancia es excelente por lo que las pacientes mantienen la calidad de vida durante más tiempo. Sin duda, estos excelentes resultados suponen un hito en el tratamiento del cáncer, aparte de lo que ya supone para las pacientes con cáncer de ovario, sobre todo porque abre una nueva vía de diseño de fármacos dirigidos por el perfil genómico del tumor.
El olaparib es un fármaco clasificado como inhibidor poli (ADP-ribosa) polimerasa que bloquea en las células tumorales el mecanismo de reparación del DNA por escisión de bases en una única hebra, y que en las células con mutaciones en BRCA 1 o 2 provoca que en pocas divisiones celulares, el daño en el DNA sea tan grande que la célula no pueda sobrevivir. Es el objetivo del olaparib, impedir que las células con mutaciones en BRCA 1 o 2 mueran por acumulación de millones de errores en su DNA. Esta hipótesis ha sido confirmada en ensayos clínicos en mujeres con cáncer de ovario recidivado y que han respondido a un tratamiento previo con cisplatino o carboplatino, permitiendo casi triplicar el tiempo sin progresión de la enfermedad comparado con un grupo de pacientes que recibieron sólo placebo; además la tolerancia es excelente por lo que las pacientes mantienen la calidad de vida durante más tiempo. Sin duda, estos excelentes resultados suponen un hito en el tratamiento del cáncer, aparte de lo que ya supone para las pacientes con cáncer de ovario, sobre todo porque abre una nueva vía de diseño de fármacos dirigidos por el perfil genómico del tumor.Este es un ejemplo más de una máxima que dicha por George Bernard Shaw en los albores de la Primera Guerra Mundial, sigue estando por suerte muy presente: "la ciencia nunca resuelve un problema sin crear otros 10 más". Olaparib ha abierto una nueva ruta científica no exenta de decenas de interrogantes.
0 comentarios - 201619abr
Genome Editing: el gran tsunami
A principios de 2013, varios documentos, surgieron como un tsunami en la comunidad científica, mostrando cómo la tecnología de Genome Editing podría utilizarse para editar los genomas de las células madre humanas pudiendo alterar el organismo completo.

A finales de 2014, los científicos habían utilizado esta tecnología para mejorar la resistencia a plagas en el trigo, reproducir los efectos cancerígenos de determinadas translocaciones cromosómicas en ratones, y corregir en ratones adultos una mutación que en los humanos provoca una enfermedad llamada tirosinemia hereditaria. Sin embargo, el uso potencial éticamente más complicado de Genome Editing se puso de relieve en febrero de 2014, cuando un equipo de investigadores describieron cómo habían utilizado esta tecnología para realizar cambios precisos en los genomas de embriones del mono Cynomolgus Monkey (monos macacos que son genéticamente tan cercanos a los humanos que comúnmente son utilizados para el estudio de enfermedades genéticas).
En noviembre de 2015 se publicó en Nature el caso de Layla, una niña de un año de edad, diagnosticada de una leucemia aguda refractaria a los tratamientos actuales, y en remisión completa tras un tratamiento de Genome Editing. Este artículo ha abierto una línea de investigación muy esperanzadora para enfermedades monogénicas, es decir, para aquellas en las una determinada mutación es la responsable de la enfermedad.
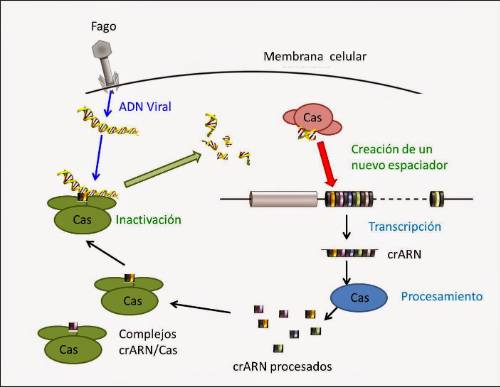
La tecnología Genome Editing consiste en aprovechar un sistema natural presente en las células procariotas para adquirir inmunidad frente a infecciones por bacteriofagos, y adaptarlo como terapia para enfermedades genéticas en humanos. Sin embargo, su uso es mucho más amplio, ya que antes se había utilizado y se está utilizando como un método de investigación en genética y en otras áreas como la agricultura, etc.
De este sorprendente mecanismo descubierto recientemente resaltan varias cuestiones muy interesantes para la ciencia:
1) En primer lugar abre un esperanzador camino para el tratamiento de enfermedades inicialmente monogénicas, pero por supuesto también para enfermedades poligénicas, aunque sin duda para esto necesitaremos otra década más de incesante trabajo. Recientemente ha sido aprobado por el NIH (National Institutes of Health, de los Estados Unidos) un protocolo clínico para el tratamiento de la mucopolisacaridosis tipo I (síndrome de Hurler), y se espera la próxima aprobación para la mucopolisacaridosis tipo II (síndrome de Hunter) y para la enfermedad de Gaucher en la primera mitad de 2016 . Por lo que en los siguientes años es muy probable que haya una eclosión de tratamientos para enfermedades genéticas hasta ahora incurables, gracias a la tecnología Genome editing.
2) En segundo lugar, se ha descubierto un nuevo modo de producción de fármacos dirigidos de forma más eficiente frente a las células que consideramos diana por presentar un determinado marcador. Es un paso más en la medicina de precisión y supera al desarrollo de los anticuerpos monoclonales dirigidos frente a epítopos presentes en la membrana de las células. La tecnología Genome Editing puede resolver muchas de las resistencias que tenemos hoy día frente a las terapias actuales, ya que aborda el problema desde el origen, al tratar el conjunto de mutaciones presentes en el genoma de dichas células. En este sentido se va a iniciar un ensayo fase 1 y 2 que implicará la inserción de una copia del gen FIX humano en nueve enfermos con hemofilia B severa y refractaria a otros tipos de terapias.
3) En tercer lugar, y no el último, ya que seguro que las dudas que se plantear son muchas, es el descubrimiento de cómo una secuencia repetitiva del DNA para la cual no se conocía su función, es un mecanismo fundamental en las bacterias para adquirir inmunidad frente a los virus. En el genoma humano, solo conocemos un 1% de la función, y el resto es desconocido incluso para los más expertos criptólogos, por lo que el descubrimiento del sistema CRISPR-CAS abré la puerta a una hipótesis planteada desde el momento que se secuenció el genoma humano en el 2003: el funcionamiento de nuestro organismo viene determinado por ese 99% de material genético para el que desconocemos su función, y es foco de atención para biólogos, bioinformáticos, matemáticos, etc. puesto que esconde gran parte de los misterios del ser vivo.
La terapia Genome Editing ha surgido como una estrategia terapéutica que pueden modificar el DNA dentro de las células y tejidos afectados por la enfermedad, sin embargo, actualmente está sólo disponible para enfermedades que están provocadas por mutaciones en un único gen, muy penetrantes y refractarias a otros tratamientos con un pronóstico vital ominoso a corto plazo, como la inmunodeficiencia combinada severa, la hemofilia y ciertas deficiencias enzimáticas; sin embargo, cuando dispongamos de los resultados de los ensayos clínicos, se abrírá las puertas a otros pacientes y otras enfermedades, inicialmente monogénicas y quizás en un futuro poligénicas. Ese 1% de nuestro material genético conocido, está formado por unos 25.000 genes, de los cuales en unos 3.000 se han encontrado mutaciones relacionadas con enfermedades, por lo tanto Genome Editing, es sólo la punta del iceberg de una tecnología que está siendo ya un tsunami, y continurá en los próximos años.
Para más información: CRISPR-CAS 9 (20.5 KB) (3 páginas)
0 comentarios - 20165abr
¿Quién se puede beneficiar una consulta por un experto en genética en cáncer ?
A priori la respuesta es sencilla, ya que todas las personas independientemente de que tengan cáncer o no, y del número de familiares con cáncer, se pueden beneficiar.
 Sin embargo, debemos ser prudentes, y establecer un filtro que nos indique que personas o familias tienen más riesgo, con el fin de que estas tengan facilidades para ser atendidas y no se demore la visita. Es responsabilidad de todos respetar este orden de prioridades porque al fin y al cabo, lo que queremos es que toda la población reciba la mejor asistencia posible.
Sin embargo, debemos ser prudentes, y establecer un filtro que nos indique que personas o familias tienen más riesgo, con el fin de que estas tengan facilidades para ser atendidas y no se demore la visita. Es responsabilidad de todos respetar este orden de prioridades porque al fin y al cabo, lo que queremos es que toda la población reciba la mejor asistencia posible.No es una tarea fácil hacer este escrutinio, y aunque hoy os mostraré unos criterios, estos varían constantemente a medida que avanza el conocimiento en la genética del cáncer, por lo que no es de extrañar que estas recomendaciones puedan cambiar.
Si pensamos un poco, la población quiere sobre todo saber si tienen un riesgo más alto del que se considera normal, y si pueden hacer algo por disminuirlo o al menos realizar todo lo posible para que en el peor de los casos, les sea detectado precozmente. Cualquier persona asume bien que tiene un riesgo de enfermar y que este aumenta con la edad, y reacciona cuando intuye que el riesgo está aumentado. En este sentido, un primer paso es discernir a las personas con un riesgo bajo (entendido como el riesgo que tiene cualquier persona como consecuencia de la edad), de aquellas que tienen un riesgo aumentado. Para esta primera tarea es muy importante valorar el número de antecedentes con cáncer que hay en la familia, y sobre todo contar los llamados antecedentes de primer grado (es decir, padres, hermanos o hijos). Y un segundo paso, es preguntarse por la edad de estos casos ("¿ son mayores de 50 años o menores ?").
Primera regla:
"Cualquier persona con un antecedente familiar de primer grado (padres, hermanos o hijos) menor de 50 años con cáncer debería recibir un asesoramiento por un experto en genética en cáncer "
Lo siguiente que seguramente nos vamos a cuestionar es si todos los casos tienen el mismo riesgo de ser hereditarios, y la respuesta es que no. Hay determinados tumores como el cáncer de mama, ovario, endometrio, colon, próstata, estómago, páncreas, riñón, tiroides y melanoma, donde la asociación familiar es más clara, sin embargo, en otros como cáncer de pulmón, laringe, esófago, hígado, etc, es más rara. Sin embargo, los avances en el conocimiento de la genética en cáncer son vertiginosos, y aunque hoy no quede claro para todos los tumores, es muy probable que en un futuro pueda clarificarse. Por lo tanto, y a modo de resumen, esta sería nuestra segunda regla.
Segunda regla:
"Si se cumple la primera regla y además el antecedente familiar de primer grado es un cáncer de mama, ovario, endometrio, colon, próstata, estómago, páncreas, riñón, tiroides o melanoma, debe ser valorado por un experto en genética en cáncer"
Pero vamos a complicarlo un poco. Si no se cumplen estas dos reglas, aunque si una, posiblemente el riesgo de cáncer será igual a cualquier persona sin antecedentes familiares, pero puedes hacer este ejercicio de memoria: revisa si hay casos de cáncer entre tus primos/as o tíos/as, tanto por la rama de tu madre como de tu padre, y si encuentras más antecedentes familiares, deberías ser igualmente valorado en una consulta experta. En estos casos el riesgo aumentará dependiendo del número de familiares con cáncer, del grado de parentesco entre ellos, y de los tipos de tumores que se hayan detectado, sin embargo, esto es una labor tediosa que debe ser realizada por un especialista para que sea lo más exhaustiva posible. Con esto ya tendríamos la tercera regla.
Tercera regla:
"Si tienes familiares de primer y segundo grado con cáncer (primos/as y/o tíos/as), el riesgo de cáncer puede aumentar dependiendo del número de casos, relación de parentesco entre ellos y tipo de tumores, pero esto es una tarea que debe ser realizada por un experto"
Pero el tema todavía es más complejo, por ejemplo, hay algunos casos de cáncer que por sus características ya nos indican que pueden existir un riesgo familiar, puesto que su origen puede ser una alteración genética. La lista cada vez va aumentando más a medida que se van analizando la secuencia genómica de los tumores pero si quisiéramos hacer un pequeño recordatorio en nuestra cabeza, deberíamos prestar especial atención a los siguientes.
Cuarta regla:
" Pon especial atención en estos casos dado que deberían ser valorados por un experto en genética del cáncer:
- Cáncer de mama triple negativo
- Cáncer de ovario
- Cáncer de colon derecho
- Cáncer gástrico tipo difuso
- Cáncer de corteza suprarrenal
- Cáncer medular de tiroides
- Rabdomiosarcoma
- Osteosarcoma
- Retinoblastoma
- Astrocitoma subependimario de células gigantes (SEGA)
- Feocromocitoma
- Angiomiolipoma renal sobre todo bilateral
- Hemangioblastoma cerebeloso
- Tricolemoma
Por último y para quien quiera profundizar en este tema os dejo el enlace a una App realizada en el Guy´s and St. Thomas NHS Foundation de Londres que mediante un breve cuestionario identifica a las familias con riesgo de cáncer hereditario y que deben ser evaluados en una consulta especializada. Pero recordar lo más importante, el beneficio del estudio del riesgo de cáncer es máximo para unas familias determinadas y pequeño para otras, aunque indudablemente todas obtienen un beneficio informativo, por lo que se debe actuar con sentido común para que sean las familias con un riesgo real basado en las cuatro reglas que os he dado las que puedan ser evaluadas por un experto rápidamente y sin demora.
Referencia: https://itunes.apple.com/us/app/cancer-genetics/id999802455?mt=8

- 201628mar
Los 100.000 Genomes
Sin duda uno de los proyectos más ambiciosos e importantes en el momento actual es el proyecto de los 100000 Genomes, que desvelará las claves para poder desarrollar la medicina personalizada o de precisión.
 Es de agradecer al gobierno británico la financiación de proyectos que marcarán un antes y un después en el modo de ejercer la medicina y que supondrán un avance tremendo en el conocimiento de muchas enfermedades muy prevalentes como el cáncer y enfermedades raras. La apuesta es tremenda, así como la inversión económica, pero esta capacidad visionaria que ha tenido el gobierno de David Cameron, está ya revolucionando el modo de trabajo en Inglaterra, y está siendo copiado por otros países como Estados Unidos, Canadá, Australia y China.
Es de agradecer al gobierno británico la financiación de proyectos que marcarán un antes y un después en el modo de ejercer la medicina y que supondrán un avance tremendo en el conocimiento de muchas enfermedades muy prevalentes como el cáncer y enfermedades raras. La apuesta es tremenda, así como la inversión económica, pero esta capacidad visionaria que ha tenido el gobierno de David Cameron, está ya revolucionando el modo de trabajo en Inglaterra, y está siendo copiado por otros países como Estados Unidos, Canadá, Australia y China.Los avances científicos requieren la colaboración de muchos equipos de investigación y compartir la información disponible. Esta es la máxima que lidera el proyecto de los 100000 Genomes y supone un tipo de organización en red, con múltiples nodos que trabajan al unisono, una distribución de la actividad dependiendo de los objetivos alcanzados, y traslación de la información clínica y molecular del paciente. Sin duda, una organización perfecta, en la que participan diversas instituciones, tanto sanitarias, como académicas o privadas, con un único objetivo, aportar todo el conocimiento que esconde el genoma a enfermedades como el cáncer, y para las que hoy día, parece que existe un techo terapéutico.
El objetivo final es crear un nuevo servicio de medicina genómica para el National Health Service (NHS) que combine los datos de la secuencia genómica con el historial médico de los pacientes, con el fin de utilizar la genómica en la asistencia sanitaria y conocer la mejor manera de interpretar los datos para ayudar a los pacientes.
Paralelamente se están realizando con esta información, conceptualizada como Big Data, múltiples investigaciones que pretenden averiguar las causas, el diagnóstico y el tratamiento de la enfermedad. Y por último, y casi lo más importante puesto que justifica el retorno económico de esta inversión, es poner en marcha la industria de la genómica en el Reino Unido, lo que les situaría en los primeros puestos, ya que el proyecto 100000 Genomes es el mayor proyecto de secuenciación genómica en el mundo, y origen de Genomics England, una sociedad totalmente controlada y financiada por el Departamento de Salud.
Pero aún hay más, este nuevo modo de trabajo, perfectamente entendible en el mundo globalizado en el que vivimos, ha supuesto la unión de otros proyectos similares a nivel mundial, y este espíritu de colaboración ha permitido el lanzamiento por parte del National Institute of Health de los Estados Unidos, de la plataforma comercial Seven Bridge diseñada para el almacenaje seguro de la información de los pacientes con las necesarias protecciones exigidas por la legislación de cada país. El compromiso de Seven Bridge es que elcumplimiento de estos requisitos sea evaluado de modo independiente y firmado por el propio gobierno.
Entramos aquí en un tema muy complicado y de la máxima importancia en seguridad nacional; veremos en unos años si el interés científico de compartir la información de los pacientes puede con el cumplimiento de la normativa de protección de datos de cada uno de los países, lo cual es un imperativo legal. En este sentido Seven Bridge está dispuesto a entrar en las cláusulas del contrato modelo para apoyar el tratamiento de los datos transferidos desde Europa a los EE.UU.
De momento, el proyecto de los 100000 Genomes se está ya preparando para almacenar esa información en un lugar seguro y de acceso restringido al público, eligiendo un lugar emblemático que nos revela la trascendencia que tiene esta información y la importancia que el gobierno de Gran Bretaña da al proyecto, en el Health and Social Care Information Centre cuya nueva sede está en una base militar de Oxford.
Sin duda, los resultados de estos formidables estudios, marcarán un punto de inflexión en el modo de ejercer la medicina y todos los conocimientos, medios diagnósticos y tratamientos que emergan, serán fruto de un conjunto de personas, grandes investigadores por supuesto, que dejan atrás su protagonismo individual en favor de unos objetivos globales trascendentes para la ciencia.
Esperemos que otros países puedan seguir estos pasos ya que de otro modo será complicado subirnos al tren de la ciencia en unos pocos años.
Referencia:
100000 Genomes project: http://www.genomicsengland.co.uk/

Seven Bridge project: https://www.sbgenomics.com/
 0 comentarios
0 comentarios
El cáncer es una enfermedad genética. Aunque parece simple y obvio, hemos tardado más de 1.500 años en llenar a esta conclusión. Cada vez se diagnostican más pacientes con mutaciones genéticas y las implicaciones para ellos y sus familias se amplían día tras día, lo que está suponiendo el desarrollo de una nueva disciplina, la medicina de precisión o personalizada. En este blog os comentaré los distintos avances que están surgiendo en este campo y cómo van a afectar tanto a los pacientes como a los profesionales.
La finalidad de este blog es proporcionar información de salud que, en ningún caso sustituye la consulta con su médico. Este blog está sujeto a moderación, de manera que se excluyen de él los comentarios ofensivos, publicitarios, o que no se consideren oportunos en relación con el tema que trata cada uno de los artículos.
Quirónsalud no se hace responsable de los contenidos, opiniones e imágenes que aparezcan en los "blogs". En cualquier caso, si Quirónsalud es informado de que existe cualquier contenido inapropiado o ilícito, procederá a su eliminación de forma inmediata.
Los textos, artículos y contenidos de este BLOG están sujetos y protegidos por derechos de propiedad intelectual e industrial, disponiendo Quirónsalud de los permisos necesarios para la utilización de las imágenes, fotografías, textos, diseños, animaciones y demás contenido o elementos del blog. El acceso y utilización de este Blog no confiere al Visitante ningún tipo de licencia o derecho de uso o explotación alguno, por lo que el uso, reproducción, distribución, comunicación pública, transformación o cualquier otra actividad similar o análoga, queda totalmente prohibida salvo que medie expresa autorización por escrito de Quirónsalud.
Quirónsalud se reserva la facultad de retirar o suspender temporal o definitivamente, en cualquier momento y sin necesidad de aviso previo, el acceso al Blog y/o a los contenidos del mismo a aquellos Visitantes, internautas o usuarios de internet que incumplan lo establecido en el presente Aviso, todo ello sin perjuicio del ejercicio de las acciones contra los mismos que procedan conforme a la Ley y al Derecho.


















